薬理学 研究内容
“筋線維芽細胞への転換を抑制する”という新しいコンセプトに基づく“線維化抑制薬”の開発に向けた基盤研究
線維化は脳以外のあらゆる臓器・組織で発症し、線維化を発症した臓器は最終的に機能不全へと陥る。線維化による臓器機能障害は、平滑筋型アクチン(α-SMA)をマーカーとして発現する筋線維芽細胞から盛んに分泌される細胞外基質により、組織の弾力性や強度・機能が損なわれることにより引き起こされる。線維化の進行により種々の臓器が機能不全に陥るため、この進行を止めるべく“線維化抑制薬”の開発が、試みられている。
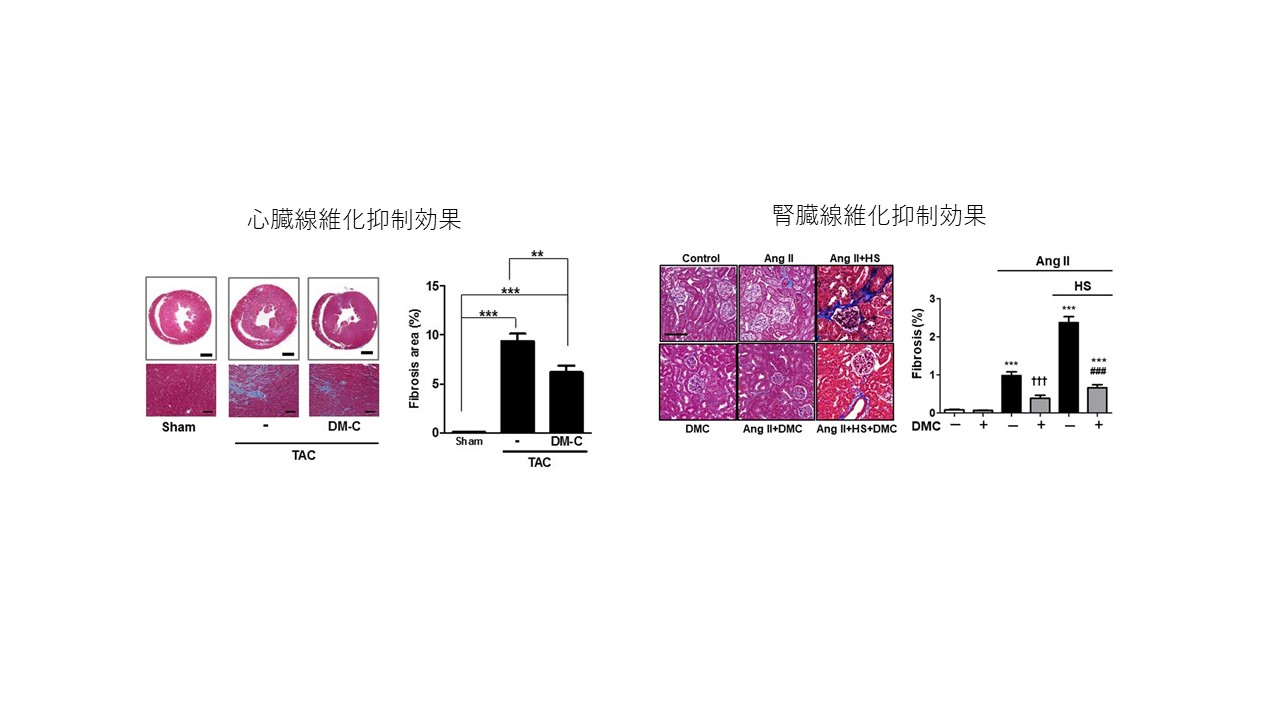
我々はコキシブ系薬物(COX-2阻害作用により抗炎症作用を発揮するcelecoxibとCOX-2阻害活性を持たない誘導体、2,5-dimethylcelecoxib(DMC))が複数の心肥大モデルにおいて心臓の、また高血圧モデルにおいて腎臓の線維化を抑制することを報告している。この線維化抑制作用は、種々の細胞から筋線維芽細胞への転換抑制が関与していることを示唆するデータが得られており、その詳細について検討を進めている。
【参考文献】
-
Ishikane
S,
Arioka
M,
Takahashi-Yanaga
F.
Promising small molecule anti-fibrotic agents: newly developed or repositioned drugs targeting myofibroblast transdifferentiation.
Biochemical Pharmacology. 2023. Aug;214:115663. -
Ikushima
E,
Ishikane
S, Kishigami
T, Matsunaga
H, Igawa
K, Tomooka
K,
Nishimura
Y, Takahashi-Yanaga
F.
2,5-Dimethylcelecoxib attenuates cardiac fibrosis caused by cryoinjury-induced myocardial infarction by suppressing the fibroblast-to-myofibroblast transformation via inhibition of the TGF-β signaling pathway.
Biochemical Pharmacology. 2022 Mar;197:114950. - Yamamoto M, Takahashi-Yanaga F, Arioka M, Igawa K, Tomooka K, Yamaura K, Sasaguri T. Cardiac and renal protective effects of 2,5-dimethylcelecoxib in angiotensin II and high-salt-induced hypertension model mice. Journal of Hypertension. 2021 May. 39(5): 892-903.
- Morishige S, Takahashi-Yanaga F, Ishikane S, Arioka M, Igawa K, Kuroo A, Tomooka K, Shiose A, Sasaguri T. 2,5-Dimethylcelecoxib prevents isoprenaline-induced cardiomyocyte hypertrophy and cardiac fibroblast activation by inhibiting Akt-mediated GSK-3 phosphorylation. Biochem Pharmacol. 2019; 168: 82-90.
- Fujita A, Takahashi-Yanaga F, Morimoto S, Yoshihara T, Arioka M, Igawa K, Tomooka K, Hoka S, Sasaguri T. 2,5-Dimethylcelecoxib prevents pressure-induced left ventricular remodeling through activation of GSK-3. Hypertens Res. 2017;40:130-139.
細胞性粘菌由来分化誘導因子に関する研究
細胞性粘菌が産生する分化誘導因子differentiation-inducing
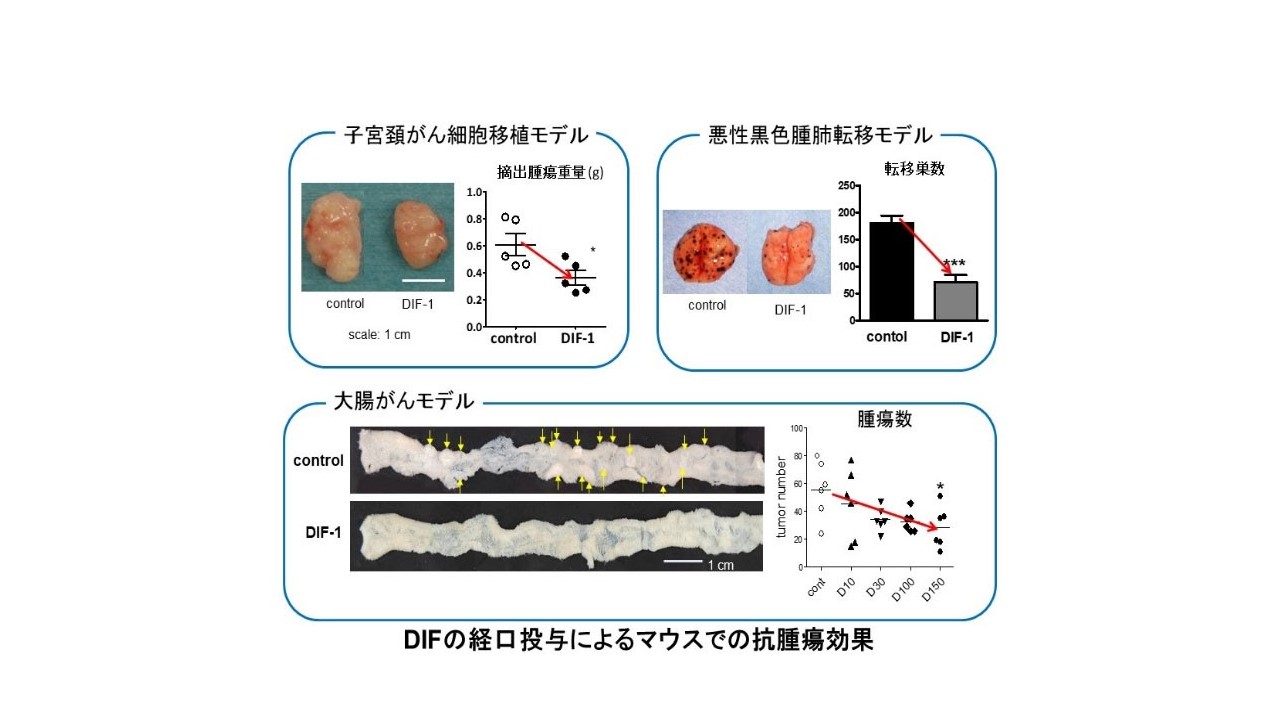
factor(DIF)は、ヒトを含めた哺乳類細胞へも作用する。我々はDIFが強力に種々のがん(子宮頸癌、扁平上皮癌、大腸癌、悪性黒色腫、骨肉腫)の増殖を阻害することを見出した。その作用機序について検討を行い、DIFがグリコーゲン合成酵素キナーゼ-3(GSK-3)の活性化をその分子基盤として、G1期からS期への細胞周期の進行に関わる主要な因子であるcyclin
D1およびc-Mycの蛋白質分解を促進することと、がんの形成・増大に深く関わるWnt/β-カテニンシグナル伝達経路を抑制することを見出した。
また、複数のがんモデル動物(担癌モデルマウス、大腸がんモデルマウス、悪性黒色腫肺転移モデルマウス)にDIFを経口投与することにより、腫瘍の増殖抑制作用や転移抑制作用があることを報告している。
このようにDIF
はGSK-3を活性化することで、強力な抗腫瘍効果を発揮するが、その直接のターゲット分子を明らかにするには至っていない。DIFsの標的分子(受容体もしくは結合タンパク質)を同定することにより、新しいG1早期選択的な経口抗腫瘍薬が開発される可能性がある。そこで現在我々は、DIFsのターゲット分子を明らかにすることに取り組んでいる。
【参考文献】
-
A
rioka
M,
Seto-Tetsuo
F,
Inoue
T,
Miura
K,
Ishikane
S,
Igawa
K,
Tomooka
K,
Takahashi-Yanaga
F,
Sasaguri
T.
Differeniation-inducing factor-1 reduces lipopolysaccharide-induced vascular cell adhesion molecule-1 by supressing mTORC1-S6K sugbakung in vascular endotherial cells.
Life Sci. 2023 Dec 15;335:122278. - Arioka M, Takahashi-Yanaga F, Kubo M, Igawa K, Tomooka K, Sasaguri T. Anti-tumor effects of differentiation-inducing factor-1 in malignant melanoma: GSK-3-mediated inhibition of cell proliferation and GSK-3-independent suppression of cell migration and invasion. Biochem Pharmacol. 138:31-48, 2017
- Kubokura N, Takahashi-Yanaga F, Arioka M, Yoshihara T, Igawa K, Tomooka K, Morimoto S, Nakatsu Y, Tsuzuki T, Nakabeppu Y, Matsumoto T, Kitazono T, Sasaguri T. Differentiation-inducing factor-3 inhibits intestinal tumor growth in vitro and in vivo. J Pharmacol Sci. 127:446-55, 2015.
- Takahashi-Yanaga F. (2013) Activator or Inhibitor? GSK-3 as a new drug target. Biochem. Pharmacol. 86(2):191-199
- Jingushi K, Takahashi-Yanaga F, Yoshihara T, Shiraishi F, Watanabe Y, Hirata M, Morimoto S, Sasaguri T. DIF-1 inhibits the Wnt/β-catenin signaling pathway by inhibiting TCF7L2 expression in colon cancer cell lines. Biochem. Pharmacol. 2012;83:47-56.
- Yoshihara T, Takahashi-Yanaga F, Shiraishi F, Morimoto S, Watanabe Y, Hirata M, Hoka S, Sasaguri T. Anti-angiogenic effects of differentiation-inducing factor-1 involving VEGFR-2 expression inhibition independent of the Wnt/β-catenin signaling pathway. Mol Cancer. 2010; 9:245.
心臓リモデリングの病態と治療に関する研究
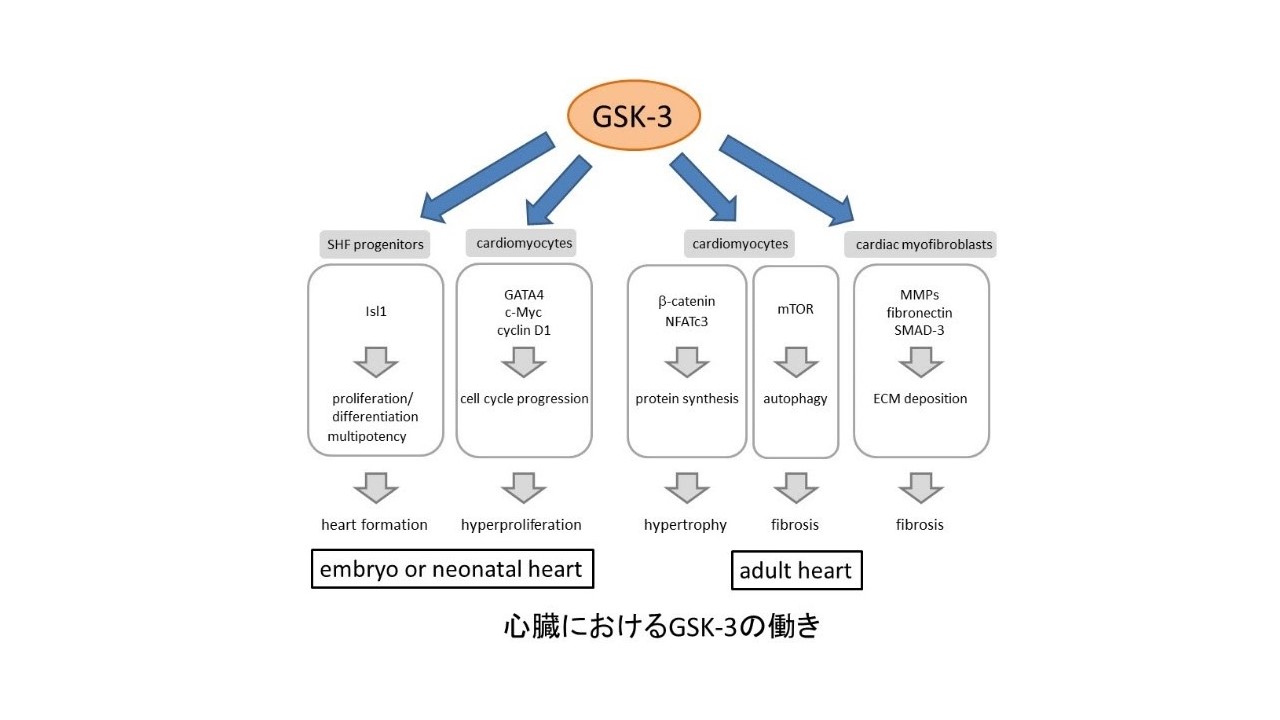
グリコーゲン合成酵素キナーゼ-3(GSK-3)は細胞質に存在するセリン/スレオニンリン酸化酵素である.この酵素は細胞増殖,幹細胞再生、アポトーシス、発達などに重要な役割を果たすさまざまなシグナル伝達経路を通じて、多彩な細胞機能を調節する分子として知られている.
GSK-3は生体内に広く分布しているが、心臓の形成や心筋細胞の増殖コントロールを通じて,心臓の発達に非常に重要な役割を果たしている。
さらに、GSK-3は心肥大や心臓の線維化においても重要な調節因子であることが明らかとなってきた。これらのことから,GSK-3は心疾患をターゲットとした新薬開発の標的分子として期待されている。
我々は、COX-2阻害作用により抗炎症作用を発揮するcelecoxibとCOX-2阻害活性を持たない誘導体、2,5-dimethylcelecoxib(DMC)が、GSK-3を活性化することを見出した。そこでcoxib系化合物が心筋障害に及ぼす効果を調べたところ、拡張型心筋症モデルマウスを用いた検討では、celecoxibおよびDMCは、心臓リモデリング(肥大・線維化)を顕著に抑制し、心機能および生命予後を改善した。また、横行大動脈縮窄(TAC)による圧負荷心不全モデルを用いた検討でも、canonical
Wnt系抑制により心肥大・線維化が顕著に抑制され、心機能を改善した。現在、coxib系化合物の影響を、特に線維化抑制作用に焦点を当て検討している。
【参考文献】
-
Kishigami
T,
Ishikane
S,
Arioka
M,
Igawa
K,
Nishimura
Y,
Takahashi-Yanaga
F.
2,5-Dimethyl-celecoxib induces early termination of inflammatory responses by transient macrophage accumulation and inhibits the progression of cardiac remodeling in a mouse model of cryoinjury-induced myocardial infarction.
J Pharmacol Sci. 2024 Feb;154(2):97-107. doi: 10.1016/j.jphs.2024.01.001. -
Ikushima
E,
Ishikane
S, Kishigami
T, Matsunaga
H, Igawa
K, Tomooka
K,
Nishimura
Y, Takahashi-Yanaga
F.
2,5-Dimethylcelecoxib attenuates cardiac fibrosis caused by cryoinjury-induced myocardial infarction by suppressing the fibroblast-to-myofibroblast transformation via inhibition of the TGF-β signaling pathway.
Biochemical Pharmacology. 2022 Mar;197:114950. doi: 10.1016/j.bcp.2022.114950. - Morishige S, Takahashi-Yanaga F, Ishikane S, Arioka M, Igawa K, Kuroo A, Tomooka K, Shiose A, Sasaguri T. 2,5-Dimethylcelecoxib prevents isoprenaline-induced cardiomyocyte hypertrophy and cardiac fibroblast activation by inhibiting Akt-mediated GSK-3 phosphorylation. Biochem Pharmacol. 2019;168:82-90.
- Fujita A, Takahashi-Yanaga F, Morimoto S, Yoshihara T, Arioka M, Igawa K, Tomooka K, Hoka S, Sasaguri T. 2,5-Dimethylcelecoxib prevents pressure-induced left ventricular remodeling through activation of GSK-3. Hypertens Res. 2017;40:130-139.
- Takahashi-Yanaga F Roles of Glycogen Synthase Kinase-3 (GSK-3) in Cardiac Development and Heart Disease. J UOEH. 2018;40(2):147-156.
- Mohamed R, Morimoto S, Ibrahim I, Zhan D-Y, Du C-K, Arioka M, Yoshihara T, Takahashi-Yanaga F, Sasaguri T. GSK-3b heterozygous knockout is cardioprotective in a knock-in mouse model of familial dilated cardiomyopathy. Am J Physiol, Heart Circ Physiol 310:H1808-H1815, 2016
- Nonaka M, Morimoto S, Murayama T, Kurebayashi N, Li L, Wang Y-Y, Arioka M, Yoshihara T, Takahashi-Yanaga F, Sasaguri T. Stage-dependent benefits and risks of pimobendan in genetic dilated cardiomyopathy mice with progressive heart failure. Br J Pharmacol 172:2369-2382, 2015
- Fan X, Takahashi-Yanaga F, Morimoto S, Zhan D-Y, Igawa K, Tomooka K, Sasaguri T. Celecoxib and 2,5-dimethyl- celecoxib prevent cardiac remodeling inhibiting Akt-mediated signal transduction in an inherited DCM mouse model. J Pharmacol Exp Ther 338:2-11, 2011
レニン・アンギオテンシン系と癌転移の関連性に関する研究
本邦の癌罹患率は高水準で推移しており、癌の進行に伴う多臓器転移は治療成績を大幅に低下させる。しかし、マクロ転移した癌細胞を除去することは現時点においては不可能であることから、転移を未然に防ぐ転移抑制療法の開発が切望されている。癌の進行には様々な因子が関与すると考えられているが、生活習慣病である高血圧もその一つとされている。しかし、降圧治療による転移抑制効果について明確なエビデンスは得られておらず、詳細な関連メカニズムの解明が必要とされている。当研究室では、血圧調節において重要な役割を持つレニン・アンギオテンシン系(RAS)のなかでも昇圧ペプチドとして広く知られているアンギオテンシンII(Ang
II)に着目し、研究を行っている。
Ang
IIを持続的皮下投与した高血圧マウスでは、メラノーマ細胞の血行性肺転移が血圧正常マウスと比較して有意に増加した1。この肺転移の増加は、カルシウム拮抗薬の投与で血圧を低下させても改善されなかった。一方、Ang
II受容体拮抗薬の投与では血圧低下と共に肺転移の有意な抑制が確認された。また、Ang
IIを投与したマウスでは、肺への癌細胞接着が亢進していることを見出した。乳がん細胞を用いた自然転移モデルにおいても同様にAng
IIによる転移増加したことより3、RASの亢進が見られる高血圧癌患者では、血行性癌転移の発症が促進することが示唆され、適した降圧薬の選択によって転移発症リスクを抑えることができる可能性がある。
現在、Ang
IIやRAS関連ペプチドによる癌転移調節メカニズムの解析を進めるとともに、新たな癌転移抑制療法の確立を目標に臨床試験に着手している。
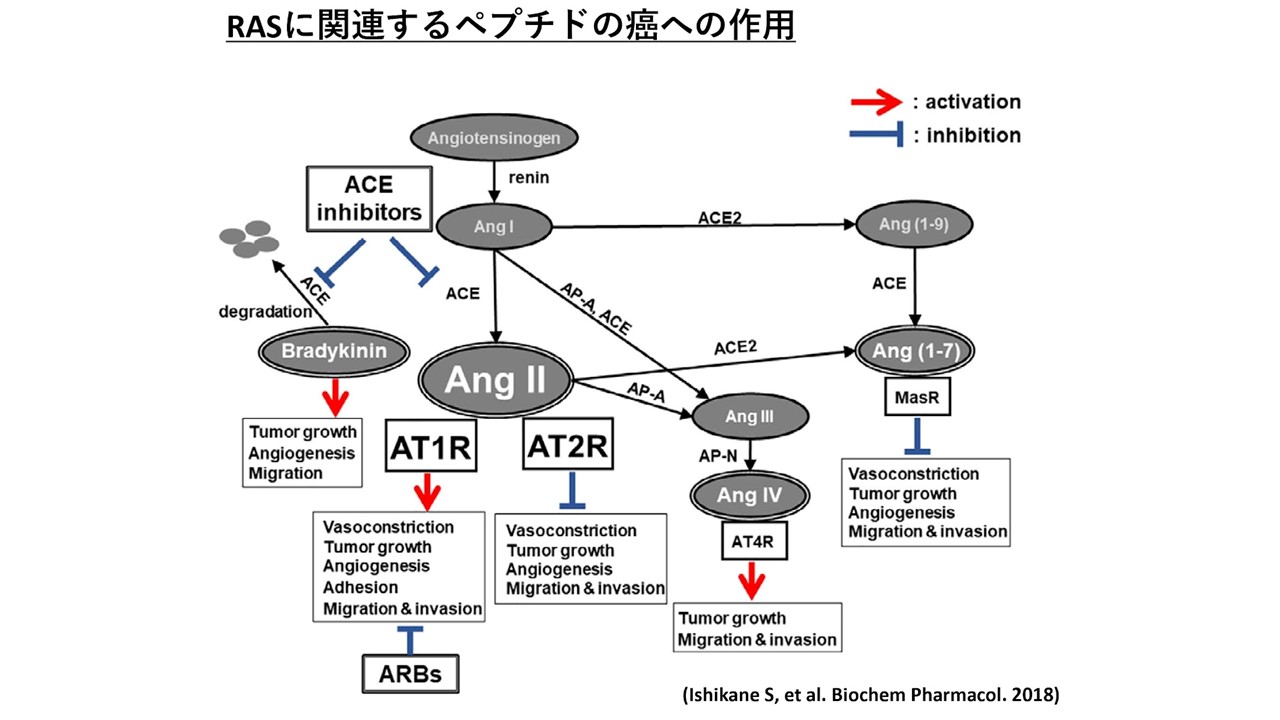
【参考文献】
-
Hirata
A, Ishikane
S,
Takahashi-Yanaga
F, Arioka
M, Okui
T, Nojiri
C, Sasaguri
T, Nakashima
N.
Increased risk of metastasis in patients with incidental use of renin-angiotensin system inhibitors: a retrospective analysis for multiple types of cancer based on electronic medical records.
Hypertension Research. 2022;45:1869-1881. - Ishikane S, Hosoda H, Nojiri T, Tokudome T, Mizutani T, Miura K, Akitake Y, Kimura T, Imamichi Y, Kawabe S, Toyohira Y, Yanagihara N, Takahashi–Yanaga F, Miyazato M, Miyamoto K, Kangawa K. Angiotensin II promotes pulmonary metastasis of melanoma through the activation of adhesion molecules in vascular endothelial cells. Biochemical Pharmacology. 2018;154:136-147.
- Ishikane S, Takahashi-Yanaga F. The role of angiotensin II in cancer metastasis: Potential of renin-angiotensin system blockade as a treatment for cancer metastasis. Biochemical Pharmacology. 2018;151:96-103.
- Takiguchi T, Takahashi-Yanaga F, Ishikane S, Tetsuo F, Hosoda H, Arioka M, Kitazono T, Sasaguri T. Angiotensin II promotes primary tumor growth and metastasis formation of murine TNBC 4T1 cells through the fibroblasts around cancer cells. European Journal of Pharamacology. 2021;909:174415.
間葉系幹細胞を用いた細胞移植療法の開発に関する研究
多能性幹細胞を用いた細胞移植療法は、難治性疾患に対する根本的治療法として期待されており、ES細胞やiPS細胞、Muse細胞等の様々な細胞を用いた基礎・臨床研究が行われている。また、幹細胞は我々の体内にも存在することが知られており、体性(組織)幹細胞と呼ばれている。当研究室では、体性幹細胞の中でも間葉系幹細胞(mesenchymal
stem
cell;
MSC)に着目して研究を行っている。
これまで、骨髄や胎児付属物である卵膜(羊膜)より多分化能を有するMSCを分離し、下肢虚血モデル1や自己免疫性心筋症モデル2等に対する細胞移植による血管新生効果や心機能改善効果について報告した。さらに、移植細胞の生着性改善を目的としてMSCシートを作製し、慢性心筋梗塞モデルラットを用いた検討では、MSCシート移植による心筋の線維化抑制作用や心機能改善効果を報告した3。
これらの研究成果をもとに、ミニブタを用いた左冠動脈前下行枝狭窄モデルにおける羊膜由来MSCシートの他家移植による心機能改善効果についての研究を行ったが、小動物モデルで見られたような改善効果は得られず、臨床応用へと発展させるためには、さらなる治療効果の改善が必要であると我々は考えている。
現在、独自に合成した化合物を用いてMSCシート移植の「生着性」や「分化効率」を改善する研究を行うとともに6、新たな心筋細胞への分化誘導因子の探索を行っており、難治性循環器疾患に対する根本的な治療法の開発を目指して研究を進めている。
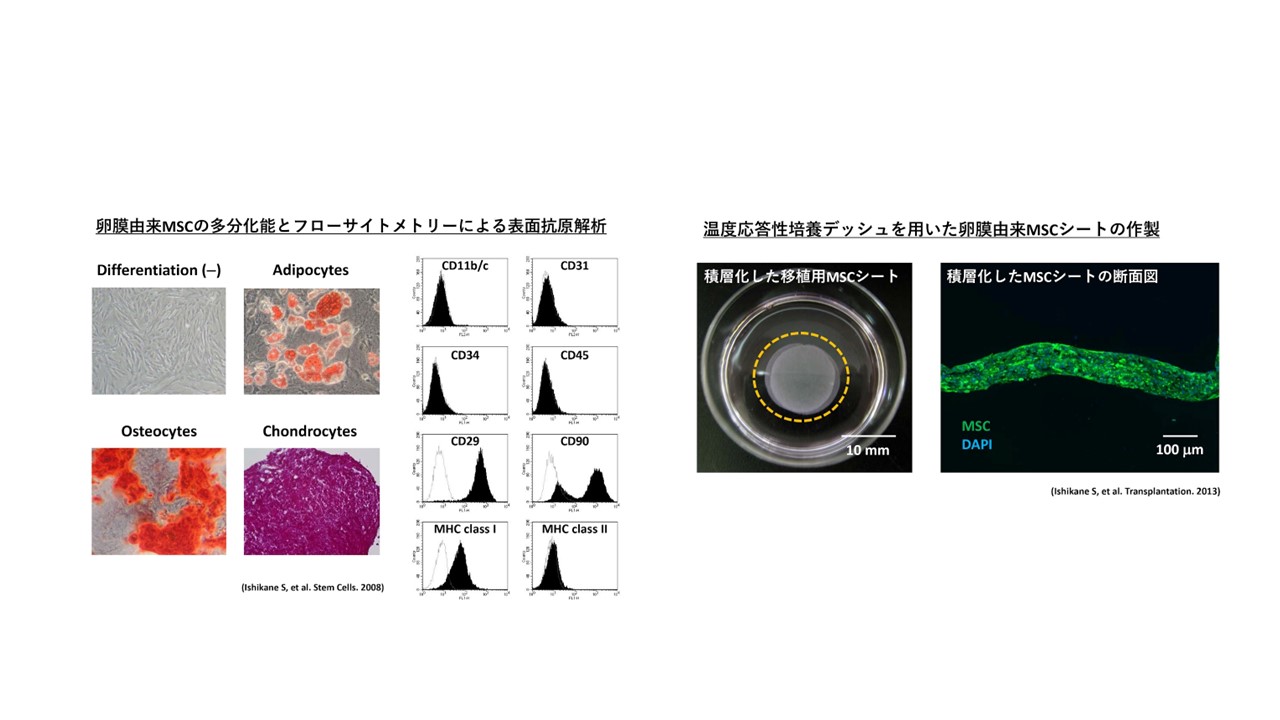
【参考文献】
- Ishikane S, Ohnishi S, Yamahara K, Sada M, Harada K, Mishima K, Iwasaki K, Fujiwara M, Kitamura S, Nagaya N, Ikeda T. Allogeneic Injection of Fetal Membrane-Derived Mesenchymal Stem Cells Induces Therapeutic Angiogenesis in a Rat Model of Hind Limb Ischemia. Stem Cells. 2008;26(10):2625-2633.
- Ishikane S, Yamahara K, Sada M, Harada K, Kodama M, Ishibashi-Ueda H, Hawakawa K, Mishima K, Iwasaki K, Fujiwara M, Kangawa K, Ikeda T. Allogeneic administration of fetal membrane-derived mesenchymal stem cells attenuates acute myocarditis in rats. Journal of Molecular and Cellular Cardiology. 2010; 49(5):753-761.
- Ishikane S, Hosoda H, Yamahara K, Kodama M, Ikeda T. Allogeneic transplantation of fetal membrane-derived mesenchymal stem cells: Therapy for acute myocarditis. Stem Cells and Cancer Stem Cells. 2012;2:341-350.
- Ishikane S, Hosoda H, Ikeda T. Therapeutic application of allogeneic feral membrane-derived mesenchymal stem cell transplantation in regenerative medicine. Tissue Regeneration. 2012;221-236.
- Ishikane S, Hosoda H, Yamahara K, Akitake Y, Kyoungsook J, Mishima K, Iwasaki K, Fujiwara M, Miyazato M, Kangawa K, Ikeda T. Allogeneic transplantation of fetal membrane-derived mesenchymal stem cell sheets increases neovascularization and improves cardiac function after myocardial infarction in rats. Transplantation. 2013; 96(8):697-706.
- Ishikane S, Ikushima E, Igawa K, Tomooka K, Fumi Takahashi-Yanaga. Differentiation-inducing factor-1 potentiates adipogenic differentiation and attenuates the osteogenic differentiation of bone-marrow-derived mesenchymal stem cells. Biochimica et Biophysica Acta-Molecular Cell Research. 2021;1868:118909.
セレコキシブの抗腫瘍効果に関する臨床研究
-抗炎症薬セレコキシブの抗がん効果等を診療録情報に基づき検討する後方視的研究-
セレコキシブは、シクロオキシゲナーゼ(COX)の阻害により抗炎症効果を発揮する非ステロイド性抗炎症薬(NSAIDs)の1つに分類されるが、COX-2への選択性が高く、従来のNSAIDsで見られるようなCOX-1阻害による出血傾向、胃腸障害、腎障害の発症は少ないとされている。日本においては、関節リウマチ、変形性関節症などへの適応を2007年に取得した。
一方、セレコキシブに抗腫瘍活性があることが多くの基礎研究および臨床研究により報告されている。特に家族性大腸腺腫症においてはポリープの再発が33~45%減少したことが報告され、米国においては家族性大腸腺腫症の治療薬として一時期用いられていた。この抗腫瘍活性がCOX-2阻害によるのかどうかについては依然議論があるが、我々は、
COX-2阻害作用を失ったセレコキシブ誘導体2,5-dimethylcelecoxib(DMC)でもマウスの腸癌を抑制することを示し、この抗がん作用は主にWnt/β‐カテニン系の抑制を介するのではないかと考えている。
しかしながら、類薬のロフェコキシブが、おそらくプロスタサイクリン産生阻害により、心血管イベントの発生率を上昇させることが報告され、セレコキシブにもそのようなリスクがあると考えられたため米国における大腸腺腫症への適応は取り消された。実際、セレコキシブの長期使用でも心血管イベント発生率が上昇するという報告はあるが3,4、そのリスク増加は一般のNSAIDsと差がないとする報告もあり5、セレコキシブを特別視することには意見が分かれている。
日本では、リウマチおよび変形性関節症の患者を対象に2つの試験が行われ、セレコキシブはむしろ他のNSAIDsより心血管イベント発生率が低い傾向にあったと報告されている。しかし、これら短期間の試験であり、またセレコキシブが導入されて日が浅かったこともあり、抗がん効果についての検討は行われていない。
このような背景に基づき、九州大学病院と産業医科大学病院との共同研究にて、セレコキシブ服用者のがん発生率を非服用者のそれと比較することにより、日本人におけるセレコキシブのがん予防効果・抗がん効果の有無を解明したいと考えている。さらに、副次評価項目として心血管イベント発症率を検討することで、セレコキシブの安全性に関する情報も検討する。
【参考文献】
- Egashira I, Takahashi-Yanaga F, Nishida R, Arioka M, Igawa K, Tomooka K, Nakatsu Y, Tsuzuki T, Nakabeppu Y, Kitazono T, Sasaguri T: Celecoxib and 2,5-dimethylcelecoxib inhibit intestinal cancer growth by suppressing the Wnt/β-catenin signaling pathway. Cancer Sci 108:108-115, 2017
- Nagano A, Arioka M, Takahashi-Yanaga F, Matsuzaki E, Sasaguri T. Celecoxib inhibits osteoblast maturation by suppressing the expression of Wnt target genes. J Pharmacol Sci. 133:18-24, 2017.
- Takahashi-Yanaga F, Yoshihara T, Jingushi K, Miwa Y, Morimoto S, Hirata M, Sasaguri T: Celecoxib-induced degradation of T-cell factors-1 and -4 in human colon cancer cells. Biochem Biophys Res Commun 377:1185-1190, 2008
- Fukada K, Takahashi-Yanaga F, Sakoguchi-Okada N, Shiraishi F, Miwa Y, Morimoto S, Sasaguri T: Celecoxib induces apoptosis by inhibiting the expression of survivin in HeLa cells. Biochem Biophys Res Commun 357:1166-1171, 2007
- Sakoguchi-Okada N, Takahashi-Yanaga F, Fukada K, Shiraishi F, Taba Y, Miwa Y, Morimoto S, Iida M, Sasaguri T: Celecoxib inhibits the expression of survivin via the suppression of promoter activity in human colon cancer cells. Biochem Pharmacol. 2006
(文責:薬理学 更新日:2023年9月25日)